Chi non ha mai messo nel proprio freezer le verdure di stagione per consumarle poi nei mesi successivi?
I risultati? Alcuni, buoni, altri ottimi e certi altri magari discutibili.
Come emerge dall’esperienza comune, il congelamento è una tecnica impiegata per la conservazione domestica e ampiamente diffusa nell’industria alimentare.
Semplificando, il concetto che sta alla base del processo è: l’acqua contenuta in un prodotto alimentare solidifica quando questo è posto ad una temperatura minore di 0 °C.
Nel primo tratto la temperatura si abbassa fin sotto il punto di congelamento (0 °C) prima che inizi la cristallizzazione. La cristallizzazione (solidificazione) avviene in due momenti specifici: la nucleazione e l’accrescimento dei cristalli di ghiaccio.
Più veloce è il raffreddamento, più i cristalli saranno numerosi e di piccole dimensioni. Più lento è il raffreddamento, meno cristalli saranno presenti e questi saranno di dimensioni maggiori. Il congelamento rapido è detto propriamente surgelazione ed è il metodo che permette di mantenere al meglio le caratteristiche qualitative di un prodotto. Con gli strumenti casalinghi generalmente non si possono ottenere i risultati possibili per l’industria.
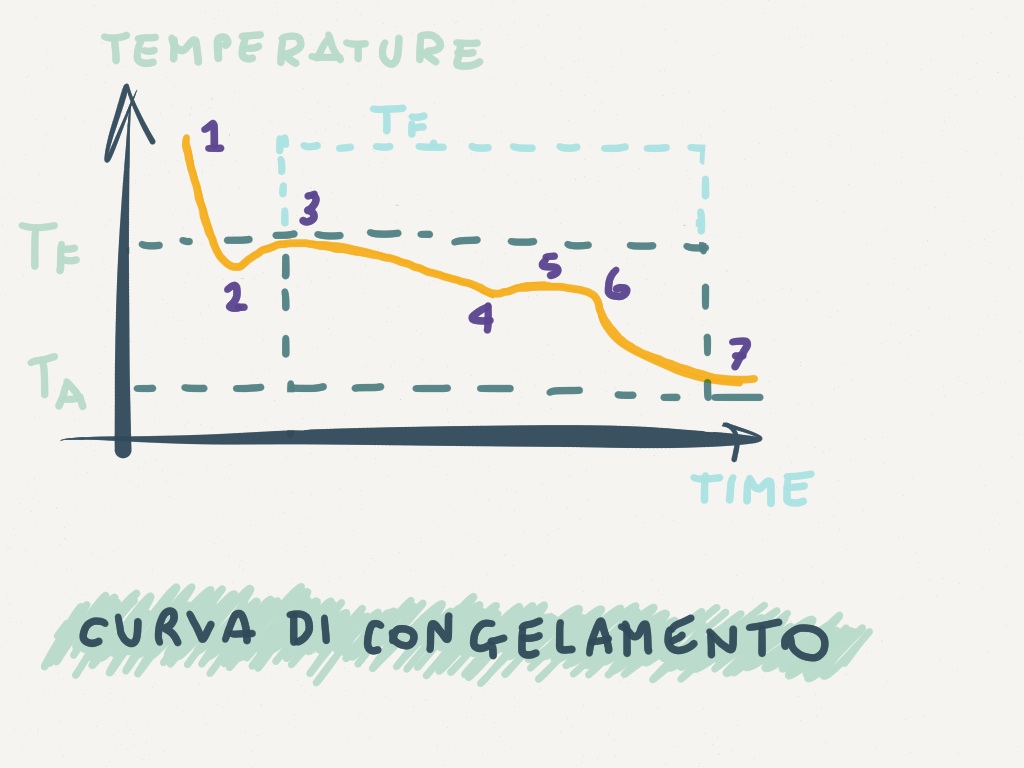
Gli alimenti sono sistemi complessi e diversi fenomeni e caratteristiche interagiscono durante questi processi (peso dell’alimento, tipo di alimento, temperatura iniziale dell’alimento,…). Schematizzando però si rappresenta graficamente il processo di congelamento relativo all’acqua. In ascissa (asse x) c’è il tempo ed in ordinata (asse y) la temperatura.
Da 1 a 2 la temperatura dell’acqua si abbassa al di sotto della temperatura di congelamento caratteristica (TF) senza che il ghiaccio inizi a formarsi. Si considera O °C per l’acqua pura.
Propriamente il punto 2 si definisce “sottoraffreddamento” o “sopraffusione”.
In 3 la temperatura arriva al punto di congelamento dove inizia la formazione dei cristalli di ghiaccio. Fino al punto 4 il ghiaccio continua a formarsi, i cristalli si strutturano. Come spiegato in un precedente post, i soluti a basse temperature tendono, per effetto del congelamento del solvente acqua, a concentrarsi e ad abbassare ulteriormente il punto crioscopico della soluzione.
Continuando il raffreddamento, la fase non congelata aumenta la propria viscosità e la cristallizzazione della stessa rallenta.
In corrispondenza del punto 5 si ha in un breve lasso di tempo un piccolo aumento di temperatura dovuto al fenomeno della “soprassaturazione” che cede calore al sistema (reazione esotermica). Continua poi la formazione di ghiaccio passando da 6 fino in 7 dove la temperatura dell’alimento è in equilibrio con quella dell’impianto o sistema congelante (TA).
Lo spazio compreso tra il punto 3 e il punto 7 indica il tempo di congelamento e come detto, l’ideale è che avvenga in tempi rapidi.
Let’s food together!





[…] Si perché, rispetto al gelato che viene servito a temperature intorno ai -10/-12 °C, questo prodotto trova il suo optimum di servizio a temperature più alte […]
[…] QUA CONGELA L’ACQUA! […]
[…] se pur il maniera semplificata, con l’effetto concentrazione (del quale abbiamo dato cenno qui) e il conseguente maggior contatto tra enzimi e […]
[…] permettendo anche lo scambio gassoso tra interno ed ambiente esterno. L’albume è ricco in acqua (circa 88%) e di proteine (circa 11%). La camera d’aria, che si forma durante la deposizione […]
[…] -Qua congela l’acqua!, Food in Progress, 2013 https://www.foodinprogress.com/qua-congela-l-acqua/ […]